Fyzikální stabilita farmaceutických disperzí
Možnosti podávání léků jsou každým dnem účinnější díky vývoji nových forem léčivých přípravků. Disperzní systémy, jako jsou emulze (jednoduché
nebo vícečetné) nebo suspenze nanočástic (oxidy kovů apod.), se v současné době hojně využívají jako nosiče léčiv nebo léčivé přípravky. Tyto nové formy
produktů umožňují lepší zacílení a vstřebatelnost pro pacienta a dávají vzniknout novým řešením ve vývoji léčiv. Stabilita těchto z podstaty nestabilních
koloidních systémů však způsobuje problémy při jejich formulaci a studiu. Analyzátor Turbiscan® (Formulaction) umožňuje detekovat, kvalifikovat
a kvantifikovat jakýkoliv destabilizační proces disperzí léčiv od vývoje nového produktu až po kontrolu jeho kvality.
Princip měření
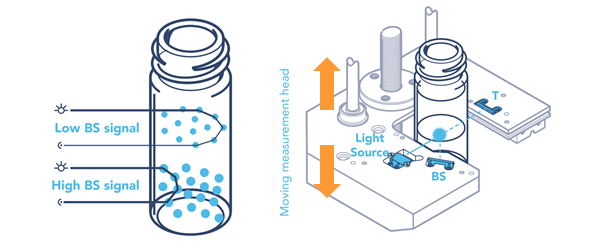
Optický skenovací analyzátor Turbiscan® využívá detekční hlavy, která se
pohybuje nahoru a dolů podél skleněné vialky s plochým dnem, viz obr. 1.
Detekční hlava se skládá z pulzního zdroje blízkého infračerveného
světla (λ = 880 nm) a dvou synchronních detektorů. Transmisní detektor
(v úhlu 180°) přijímá světlo, které prochází vzorkem, zatímco detektor
zpětného rozptylu (v úhlu 45°) přijímá světlo rozptýlené vzorkem zpět.
Detekční hlava snímá celou výšku vzorku a každých 40 µm získává data
o transmisi a zpětném rozptylu. Přístroj Turbiscan LAB® lze tepelně
regulovat od 4 do 60 °C a propojit s plně automatizovanou stanicí pro
stárnutí (Turbiscan AGS®) pro analýzy dlouhodobé stability. Zvyšování
teploty je ideálním parametrem pro urychlení destabilizačních procesů
při zachování realistických podmínek testování.
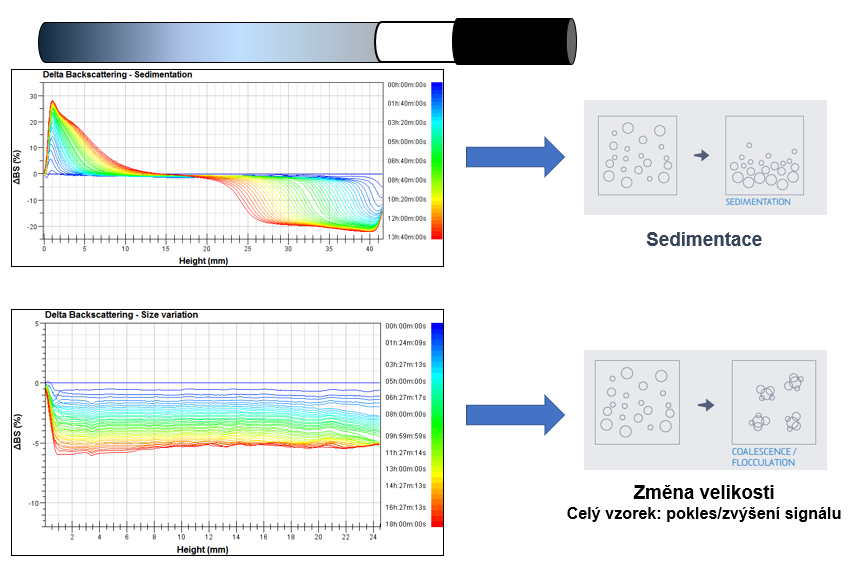
Přístroj Turbiscan® provádí snímání v různých naprogramovaných
časech, profily se překrývají v jednom grafu. Grafy se obvykle zobrazují
v referenčním režimu, kdy se první profil odečítá od všech ostatních
profilů, aby se zdůraznily rozdíly ve stabilitě. U stabilního přípravku se
všechny profily překrývají ve stejné křivce, nestabilní přípravek zobrazuje
variace profilů. Zpětný rozptyl a/nebo transmisní toky jsou zobrazeny
na ose y a výška vialky/vzdálenost ode dna na ose x. První profil je
zobrazen modře, poslední červeně, viz obr. 2.
Princip měření je založen na vícenásobném rozptylu světla (MLS),
kdy jsou fotony mnohokrát rozptýleny částicemi/kapičkami disperzí, než
jsou detekovány detektorem zpětného rozptylu. Intenzita světla zpětně
rozptýleného vzorkem závisí na třech parametrech: průměru částic,
jejich objemovém podílu (koncentrace částic) a relativním indexu lomu
mezi disperzní a kontinuální fází. Proto je optickým zařízením detekována jakákoliv změna způsobená změnou velikosti částic (flokulace,
koalescence) nebo lokální změnou objemového podílu (migrační jevy:
krémování, sedimentace).
Údaje o stabilitě a dispergovatelnosti se získávají sledováním vývoje
intenzity zpětně rozptýleného a/nebo prošlého světla v čase. V některých
případech však může být obtížné objektivně analyzovat data, například v případě současných destabilizačních jevů (např. sedimentace
a agregace). Společnost Formulaction vyvinula jednoduché a robustní
kritérium nazvané Turbiscan Stability Index (TSI), které umožňuje
rychle porovnávat a charakterizovat stabilitu formulací. TSI je součtem
všech časových a prostorových změn v posuzovaném období. Vzorek je
stabilní, pokud je TSI blízké nule. Vyšší hodnota poukazuje na destabilizaci. Pomocí databáze byla nalezena souvislost s vizuálním pozorováním, viz tab. 1.
Aplikační využití
Technologie Turbiscan® je jedinečný a kompletní nástroj, který umožňuje
studovat stabilitu koloidních disperzí bez jakéhokoliv ředění nebo úpravy
produktu. Destabilizační procesy lze snadno identifikovat a kvantifi kovat
až 200krát dříve než pouhým okem. Stanovení skladovatelnosti lze zcela automatizovat. Metoda je nedestruktivní a lze ji použít pro jakoukoliv
disperzi, tedy suspenzi, emulzi nebo pěnu. Spotřeba vzorku je velmi
malá, stanovení probíhá ve vialkách o objemu 4 nebo 20 ml.
Disperzibilita a stabilita nově vyvíjeného produktu jsou jeho klíčové
vlastnosti. Pro usnadnění jejich stanovení byl vytvořen nový model
Turbiscan DNS® (Dispersibility & Stability), viz obr. 3, který umožňuje charakterizovat disperzi od první fáze vývoje formulace až po
její finální podobu včetně doby skladovatelnosti. Klasický model měří
v klidovém stavu, nový model umožňuje provádět měření za současného míchání (funkce T-MIX) nebo přivádět pomocí peristaltické pumpy do
měřicí nádoby čerstvý roztok (funkce T-LOOP, cirkulace). Optimalizace
složení, stanovení (re)dispergovatelnosti a stability probíhá v rámci
jednoho přístroje.
V následujících odstavcích jsou popsána možná využití analyzátoru Turbiscan® pro farmaceutické aplikace, která zahrnují:
- Vakcíny: Kinetika agregace a sedimentace částic (adjuvancia, proteiny, oxidy kovů).
- Dermatologická kosmetika: Detekce koalescence a krémování až 200x rychlejší než vizuální test.
- Vývoj nových typů amorfních pevných disperzí.
Kvantifikace potenciálu redisperze hliníkových solí ve vakcínách [1]
Adjuvancia, jako je například hlinitá sůl, se běžně přidávají do
vakcín za účelem zvýšení jejich imunitní odpovědi. Ta však mohou
agregovat a následně se v průběhu času usazovat díky elektrickým nábojům. Vzniklý sediment může být více či méně kompaktní a obtížně
redispergovatelný v závislosti na síle vazeb mezi částicemi. Pro tento
účel byla vyvinuta rychlá ověřovací metoda (< 30 min) redispergovatelnosti sedimentu. Aby bylo zabráněno ztrátě imunogenicity, byl produkt
podroben řízené fl okulaci změnou pH nebo iontové síly v přítomnosti
modelového antigenu (BSA, lysozym). Výsledkem jsou slabě vázané
částice, které tvoří vločky s nízkou hustotou díky vysokému obsahu
vázané vody a lze je snadno redispergovat.
Obr. 4: Rychlost sedimentace roztoku AlPO4 v různých podmínkách zachycená snímkem po 25 minutách [1]
Charakterizace Pickeringových emulzí, využití TSI [2]
Pickeringovy emulze jsou emulze stabilizované pevnými částicemi
(50–500 nm), které se adsorbují na rozhraní mezi oběma fázemi. Jsou
používány v široké škále oblastí, jedná se například o podávání léčiv,
vezikulární, vysoce citlivé a porézní materiály, katalytické usnadnění či
zajištění bezpečnějšího složení kosmetických produktů díky jejich vysoké
stabilitě ve srovnání se systémy stabilizovanými povrchově aktivními látkami. Nejčastěji používanými částicemi ve farmacii jsou oxid křemičitý,
jíly, uhličitan vápenatý, oxid titaničitý nebo latex.
Níže je pomocí TSI (Turbiscan Stability Index) porovnána stabilita
biokompatibilních nativních cyklodextrinů pro antimykotika na bázi
soli ekonazolu určené k léčbě povrchových kožních infekcí. Všechny
vzorky vykazovaly zvýšení intenzity signálu po celé výšce vzorku, což
znamená, že dochází ke zvětšování kapek, intenzita těchto změn se však
u jednotlivých vzorků liší, jinými slovy koalescence probíhá s různou
intenzitou. Kinetiku destabilizace lze kvantifikovat pomocí TSI. Ten se
vypočítá sečtením všech změn signálu zjištěných v důsledku destabilizačních jevů (sedimentace, čiření, změny velikosti atd.). Čím vyšší je
TSI při dané době stárnutí, tím kratší je stabilita vzorku, viz obr. 5. Vyšší
stabilitu vykazovaly vzorky obsahující isopropylmyristát a gama-dextrin.
Obr. 5: Vývoj TSI v závislosti na čase po dvou dnech analýzy Pickeringových emulzí o různém složení [2]
">
Vývoj nových typů léčiv a role stability koloidních disperzí [3]
Hodnocení fyzikální stability pomocí analyzátoru Turbiscan® bylo
použito pro porovnání nově vyvinutých typů koloidních disperzí
s ritonavirem jako modelovou sloučeninou. Fyzikální nestabilita kapiček obsahujících různé koncentrace ritonaviru byla sledována přímo
v přítomnosti kandidátních polymerních přísad a bez nich při různých
teplotách. Bylo potvrzeno, že mechanismus pozorované nestability
spočívá v koalescenci kapiček kapaliny. Koalescence nanokapek se
projevuje poklesem signálu transmitance a zpětně odraženého světla
v čase, její kinetiku lze popsat pomocí exponenciálních funkcí rozpadu.
Byla prokázána účinnější stabilizace s rostoucím množstvím povrchově aktivní látky nad kritickou koncentrací micel a efekt stabilizace přidáním
dostatečného množství určitých polymerů, viz obr. 6.
Mezi největší výhody analyzátoru Turbiscan® patří kvantifi kovatelné
měření skutečné stability a její stanovení při skladování, zkrácení doby
analýzy (až 200krát rychlejší než vizuální test), schopnost detekovat
a kvantifi kovat různé typy destabilizačních procesů (sedimentace, fl okulace, krémování, aglomerace, změna velikosti), jednoduché stanovení
stabilitního indexu (TSI) pro rychlé porovnání různých typů vzorků,
úspora materiálu (minimální objem vzorku je 1 ml), možnost měření
při vysokém tlaku pro inhalátory a jeho všestrannost umožňující analýzu
všech druhů disperzí, tedy emulzí, suspenzí a pěn. Jedná se o univerzální nástroj umožňující popsat stabilitu celé řady produktů s využitím
nedestruktivního principu měření.
Účinnost vakcín velmi závisí na stavu disperze přípravku v okamžiku
podání, proto se vakcíny před použitím často rekonstituují. Fyzikální
charakterizace vakcín lze dosáhnout měřením rychlosti migrace
a fl okulace, a tak vyhodnotit stav disperze v čase. Analýza pomocí přístroje Turbiscan® je spolehlivá a velmi přesná pro optimalizaci složení
vakcín za účelem zvýšení rovnoměrnosti dávky, dosažení požadované
účinnosti a snadné rekonstituce. Pro urychlení vývoje nových přípravků
lze s výhodou využít nový model Turbiscan DNS® a provádět analýzu
stability a redispergovatelnosti za současného míchání (T-MIX) nebo
online (T-LOOP).
Tento článek byl připraven s využitím materiálů poskytnutých společností
Formulaction.
Literatura
[1] MUTHURANIA, K. Investigation of the Sedimentation Behavior of
Aluminum Phosphate: Infl uence of pH, Ionic Strength, and Model
Antigens. Pharmaceutical Research and Development; Pfi zer Inc.,
J Pharm Sci 2015, 104:3770–3781
[2] LECLERCQ, L. NARDELLO-RATAJ, V. Pickering Emulsions
Based on Cyclodextrins: A Smart Solution for Antifungal Azole
Derivatives Topical Delivery; Eur J Pharm Sci 2016, 82:126–137
[3] SUN, Y. Assesing Physical Stability of Colloidal Dispersions Using a
Turbiscan Optical Analyzer; Mol. Pharmaceutics 2019, 16, 2, 877–885
Nenechte si ujít další zajímavosti
- Vanquish Access – dostupné řešení spolehlivých HPLC analýz
- Psychoreologie a tribo-reologická charakterizace pudinků ve vztahu k textuře
- Adsorbovatelné organické fluoridy (AOF): Klíč k modernímu monitoringu PFAS ve vodě
- Elementární rozbor whisky pomocí icp-ms: detailní pohled do stopového světa oblíbeného destilátu
- Thermo Scientific Cindion C-IC (Combustion Ion Chromatography) - komplexní řešení pro stanovení celkových halogenů a síry ve složitých matricích