LC-MS okénko: Cílená kvantifikace proteinů pomocí WiSIM-DIA a Orbitrap™ Fusion™ Lumos™ tribridního hmotnostního spektrometru
03.02.2018
Extrémní složitost a velký dynamický rozsah proteinů v biologických vzorcích vyžaduje analytický přístup na nejvyšší úrovní. Rychlá tandemová hmotností spektrometrie s vysokým rozlišením hraje nejen v proteomice esenciální roli pro dosažení velmi přesných a reprodukovatelných dat. Klasický data-dependentní přístup (DDA) je tak díky vyspělému instrumentálnímu a softwarovému vybavení vyzýván data-independetními analýzami (DIA).
Thermo Scientific™ Orbitrap Fusion™ Lumos™ Tribrid™ hmotnostní spektrometr je složen z předřazeného kvadrupólu, hmotnostního analyzátoru na bázi orbitální pasti (rozlišovací schopnost 500 000 při 1.5 Hz), kolizní cely a lineární iontové pasti ( ˃20 kolizí-indukovaných disociací za 1 sekundu) (Q-OT-qIT) (Obr.1). Unikátní tribridní architektura tak dovoluje s vynikající citlivostí analyzovat selektované ionty v orbitální pasti (SIM) a paralelně provádět cílené MS n experimenty v iontové pasti.
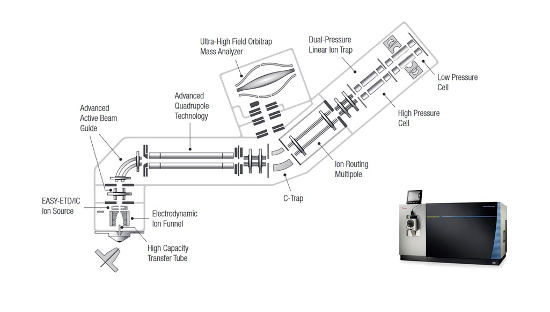
Obr. 1 - Thermo Scientific™ Orbitrap Fusion™ Lumos™ Tribrid™ hmotnostní spektrometr.
Výhody tohoto revolučního systému byly využity k vývoji nového DIA přístupu sloužícímu k citlivé a zároveň robustní kvantifikaci proteinů. Tzv. Wide selected-ion-monitoring data independent analysis (WiSIM-DIA) je složena ze tří po sobě jdoucích skenů dat o vysoké přesnosti a rozlišení (240 000 FWHM, <3 ppm). Separátní skenovaní v celkovém rozsahu 400 – 1000 m/z zachovává rozsah full-scan experimentu, avšak výrazně zvyšuje citlivost. Velký rozsah m/z selektovaných iontů v prvním kroku zvyšuje pravděpodobnost detekce a následné kvantifikace nízko abundantních proteinů. S každým SIM experimentem je souběžně v iontové pasti sbíráno 17 MS/MS fragmentačních spekter prekurzorových iontů s iozalčním oknem 12 m/z , které jsou následně použita k identifikaci peptidu na základě databázového porovnání. Toto uspořádání tak plně pokrývá každý ze třech skenů (Obr.2).
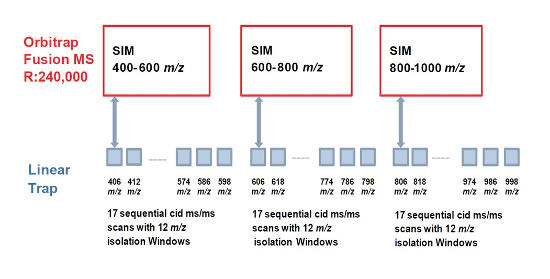
Obr. 2 – Schéma Wide selected-ion-monitoring data independent analysis (WiSIM-DIA) experimentu.
Kvantifikace proteinů je realizovaná na základě dat orbitální pasti sbíraných o vysokém rozlišení. MS/MS data z druhého kroku jsou použita pouze ke konfirmačním účelům. Koeluce necílených proteinů tak neovlivní kvantitativní stanovení, jak je tomu běžné v některých konvenčních DIA přístupech, kde jsou data získávána bez následné konfirmace.
Zmíněný přístup vykazuje díky rozdělení do třech navazujících skenů o vysokém rozlišení výrazně vyšší hodnoty poměru signálu a šumu (S/N) oproti full-scan experimetu, limit detekce (LOD) byl na ředěné sérii 14 isotopově značených peptidů vložených do matrice E.coli stanoven na 10 amol/µl, pěti bodová kalibrace byla prováděna v triplikátu, koeficient variace (% CV) byl menší než 15%. V neposlední řadě - věrohodnost identifikace peptidů na základě databázového screeningu byla verifikována velmi nízkou hodnotou p -value < 1 x 10 -4 (Obr.3).
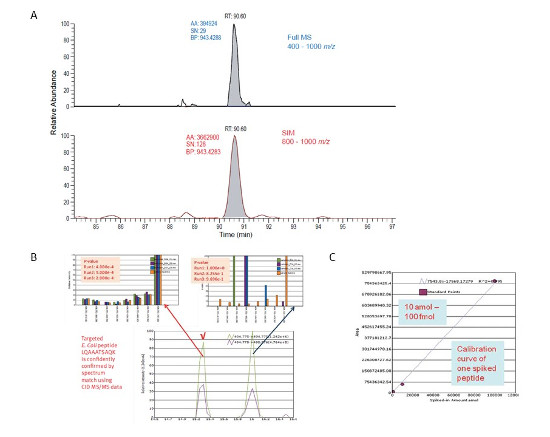
Obr. 3 – Porovnání hodnoty signál/šum (S/N) v případě full-scan a WiSIM-DIA uspořádání (A), výsledek databázového screeningu fragmentačních spekter 8 nejintenzivnějších iontů E.coli peptidu, pík v 16. min je kontaminant (B), kalibrační křivka jednoho ze 14 isotopově značených peptidů vložených do matrice E.coli (C).
Pro další aplikace a více informací Application Note 600
Nenechte si ujít další zajímavosti
- Vanquish Access – dostupné řešení spolehlivých HPLC analýz
- Psychoreologie a tribo-reologická charakterizace pudinků ve vztahu k textuře
- Adsorbovatelné organické fluoridy (AOF): Klíč k modernímu monitoringu PFAS ve vodě
- Elementární rozbor whisky pomocí icp-ms: detailní pohled do stopového světa oblíbeného destilátu
- Thermo Scientific Cindion C-IC (Combustion Ion Chromatography) - komplexní řešení pro stanovení celkových halogenů a síry ve složitých matricích