Velké procesy v malém měřítku – optimalizace parametrů extruze (Thermo Fisher Scientific)
17. 9. 2020
Proces vytlačování taveniny (HME – hot melt extrusion) je rozšířeným způsobem zpracování při vývoji nových lékových forem a zvýšení biologické dostupnosti špatně rozpustných aktivních složek. Dvoušnekový extruder se prosadil v plastikářském průmyslu, nabyté znalosti lze však využít i ve farmaceutickém průmyslu při HME nebo granulaci (TSG – twin-screw granulation), kdy jsou produktem extruze granule – bez užití výtlačné trysky. Znalost kritických parametrů procesu zpracování a jejich závislostí je nezbytná pro úspěšné převedení podmínek procesu vytlačování taveniny z laboratorního měřítka do pilotní nebo průmyslové výroby. Tento článek se zabývá přehledem parametrů a optimalizací procesu zpracování, konfigurací šneků seskládáním jednotlivých elementů a ukazuje, jak lze dosáhnout převedení podmínek z malých extruderů pro výzkum a vývoj na pilotní a menší výrobní systémy, se zaměřením na farmaceutické aplikace.
Trocha historie
Jednošnekové extrudery byly a jsou používány pro tavení polymerů a lisování, jejich výkon je ale limitovaný. Zcela naplněný šnek je pod tlakem a není možné odplyňování ani přidávání dalších součástí směsi. Kvalita mísení je také omezená. Za účelem zvýšení kvality mísení a pro potřeby kontinuálního zpracování byly vyvinuty dvoušnekové extrudery, jejichž využití při vytlačování taveniny pro farmaceutické aplikace je stále častější. Své využití nachází v mnoha oblastech a pomáhají zlepšení rozpustnosti, řízenému uvolňování, maskování svíravé chuti a lze je využít při produkci různých lékových forem (tablety, tobolky, pastilky, transdermální náplasti, imlantáty apod.) [1]. Využívání kontinuálního zpracování při výrobě léčiv je podporováno Úřadem pro kontrolu potravin a léčiv (FDA).
Extruze
Extruder musí zajistit správné dávkování složek, jejich tavení, transport, míchání, odplyňování a závěrečnou extruzi homogenizovaného produktu. Pro zajištění dávkování správného množství suroviny musí být první zóna extruderu účinně chlazena, aby se zabránilo předčasné degradaci. Dávkovat je možné pomocí gravimetrických nebo volumetrických podavačů. Výhodné je použít v dávkovací zóně takové šneky, které mají dostatečný objem pro bezproblémové zpracování komerčně dostupných granulátů i v laboratorním měřítku. Po nadávkování je vzduch vytlačován ven a materiál je vtlačován do extruderu, kudy je dále transportován. Směs polymeru s účinnou aktivní látkou se začne tavit vlivem zahřívání vnějšího pláště extruderu a smykového tření vyvolaného pohybem šneků.
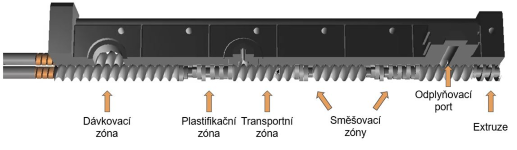
Obr. 1 – Schematické znázornění extruze
Typická pracovní délka šneku je 25–40 L/D. Variabilní nastavení délky šneku je možné. Extruder není v transportních zónách zcela naplněn a materiál není stlačován. V plastifikační zóně extruderu již dochází ke stlačování a plastifikaci. Směšovací zóna je u většiny modulárních extruderů individualizovaná, termolabilní látky tak nejsou vystaveny nadměrnému působení tepla nebo tlaku. Lze přidat chladící prvky. Tavenina může být také odplyněna do atmosféry nebo do vakua a výsledný produkt tak neobsahuje bubliny. V transportních zónách mohou být přidávány další pevné nebo kapalné složky. V závislosti na aplikaci lze využít různé geometrie výtlačných trysek. Tavenina může být chlazena pomocí odtahovacího pásu a dále sekána na granule požadovaných rozměrů.

Obr. 2 – Tryska pro vytlačování horké taveniny, řada Pharma 24 (Thermo Fisher Scientific)
Přenositelnost procesů
Pro úspěšné přenesení optimalizovaných podmínek pomocí HME do výrobního měřítka, je nutno zaznamenat všechny údaje týkající se procesu v malém měřítku při kontinuální výrobě (např. 50 g/hod.). Extruder použitý při vývoji musí být schopen transportovat materiál a vést teplo tak jako extruder, který odpovídá technické realizaci. Musí být použita stejná nebo podobná konfigurace šneků. Doba zdržení (residence time) a teplota tání musí být podobné jako v laboratorním měřítku (adiabatické podmínky). Zvyšování měřítka (škálovatelnost) je limitováno díky dostupným povrchovým úpravám, rychlost ohřevu i chlazení klesá s rostoucím průměrem šneků.
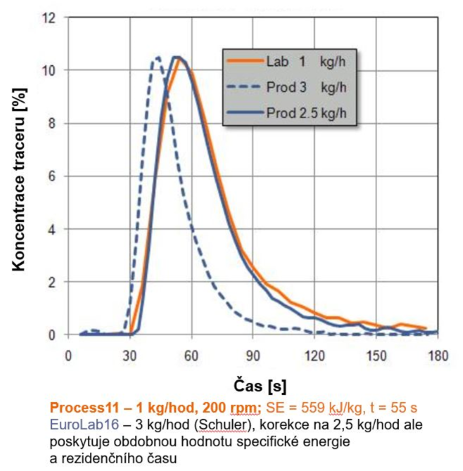
Obr. 3 – Doba zdržení na extruderu o průměru šneků 11 a 16 mm, výpočet vs. experimentální data
HME – vytlačování taveniny
Cílem HME je obvykle začlenění aktivní účinné látky (API) do polymerní matrice takovým způsobem, aby se v polymerní tavenině vytvořila homogenní disperze na molekulární úrovni podobně jako u lyofilizace či rozprašování, viz Obr. 4. Technologie HME je pro farmaceutický průmysl stále relativně málo užívaná, častěji se používá při vývoji formulací než ve výrobním prostředí. Pro převedení podmínek do výrobního prostředí je klíčová volba laboratorního extruderu a jeho parametry. Ve farmaceutické extruzi je důležitá správná teplota, která se musí nalézat pod teplotou skelného přechodu (Tg) API a výše, než je plastifikační teplota polymerní matrice (cca 50 °C), aby se zabránilo tepelnému rozkladu API. Polymer musí být netoxický. K solidifikaci směsi dochází zchlazením. Převoditelnost parametrů HME optimalizovaných při laboratorní extruzi pomáhá šetřit materiál i čas strávený při vývoji.
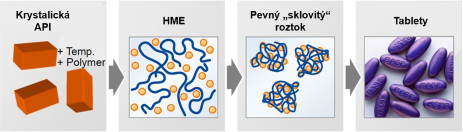
Obr. 4 – Vytlačování horké taveniny
Laboratorní farmaceutická extruze
Mezi největší výhody farmaceutické extruze v laboratorním měřítku patří zajištění kontinuální „malé“ produkce, nízká spotřeba drahých/toxických materiálů, snadné čištění, rychlé stanovení/ověření parametrů, flexibilita při vývoji nových produktů, opakovatelnost nastavených parametrů a přesně stanovená data o procesu pro audit. Kontinuální produkce v ustálených podmínkách umožňuje minimalizovat neúspěšné experimenty. Pomocí online senzorů je měřena rychlost dávkování, teplota v průběhu extruze, výstupní tlak a/nebo regulace vakua. Protokolování naměřených dat poskytuje podpůrnou dokumentaci k zajištění kvality produkčních dávek a zjednodušuje kontrolu kvality. Současné technologie umožňují výrobu nových lékových forem, např. mini-implantátů. V současné době se dostává do popředí ko-extruze, která umožňuje kontinuální produkci vícevrstvých materiálů.

Obr. 5 – Tryska pro ko-extruzi
HME navíc umožňuje snížení spotřeby rozpouštědel v porovnání s procesem mokré granulace a je šetrnější k životnímu prostředí. Extruder zpracovávající API musí být možné provozovat v rukávcovém boxu, klíčové jsou rozměry a musí být co nejkompaktnější bez přídavné elektroniky. Extrudery pro farmaceutickou extruzi musí být vyrobeny ze speciální oceli (pharma grade), nesmí mít mrtvé objemy, musí být snadno rozebíratelné, čistitelné a sterilizovatelné.

Obr. 6 – Extruder Pharma 11 (Thermo Fisher Scientific) před čistěním
Experimentální podmínky, škálovatelnost procesů
Polymer Soluplus® byl vytlačován na třech různých velikostech paralelních souběžně se otáčejících šneků. Doba zdržení a distribuce byla měřena pomocí traceru Fe 2 O 3 . Vypočítána byla specifická spotřeba (mechanické) energie. Z obvyklých parametrů byla měřena teplota a tlak taveniny na výtlačné trysce a kroutící moment. Z distribuce doby zdržení byla vypočtena střední doba zdržení, ta byla získána měřením koncentrace barevného pigmentu fotometrickou a kolorimetrickou metodou. Pro simulaci škálování HME byly použity tři různé velikosti extruderů o celkové délce 40 L/D: laboratorní extruder Pharma 11, pro střední měřítko Pharma 16 a pro výrobní měřítko Pharma 24 (Thermo Fisher Scientific, Karlsruhe, Německo), viz Tab. 1. Nastavena byla minimální (100 ot./min), střední (300 ot./min) a maximální (500 ot./min) rychlost otáček šneků a teplotní programy při 130, 165 a 200 °C. Rychlost extruze byla vypočítána v závislosti na Schulerově rovnici [2].
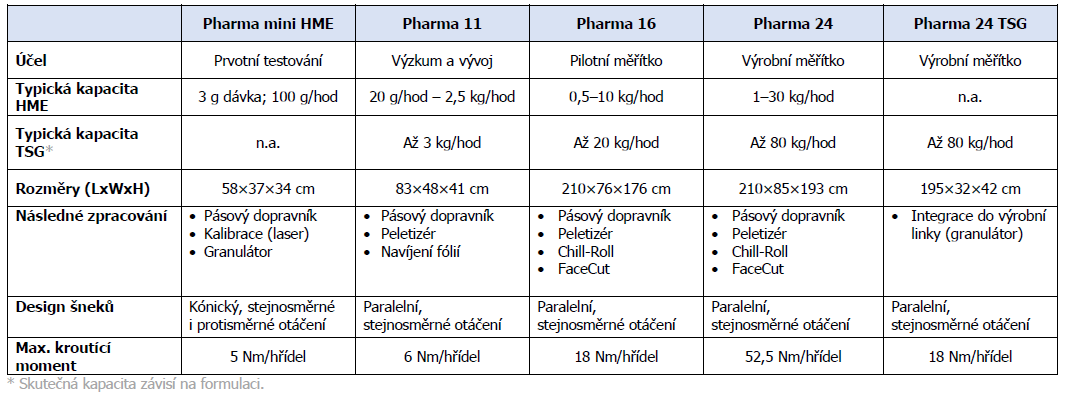
Tab. 1 – Přehled parametrů farmaceutických extruderů (Thermo Fisher Scientific)
Výsledky experimentu
Aby bylo možné použít podmínky laboratorní extruze ve větším měřítku, je nutné pracovat se stejnou dobou zdržení materiálu v extruderu. Ta umožní tavení a dostatečné promísení, a na druhé straně brání degradaci. Pomocí Schulerovy rovnice je vypočítána rychlost/kapacita linky pomocí doby zdržení. Distribuce doby zdržení je ale u pilotního měřítka úzká a kratší, zatímco u laboratorního extruderu je distribuce široká a průměrná doba zdržení delší. Z toho důvodu je nutné zahrnout korekce, jak je ukázáno na Obr. 3. Bylo zjištěno, že dokonalého překryvu distribucí doby zdržení je dosaženo, když se doba distribuce a specifická spotřeba mechanické energie (SMEC) [3], která je vypočítána z kroutícího momentu, rychlosti otáčení šneků a kapacity systému, shodují. V dalším kroku je využita znalost objemu použitých velikostí extruderů a vypočítána ANOVA. Tím je vymezeno „návrhové okno“ experimentu, které pomocí vícenásobné regrese říká, jak přenést podmínky extruze do většího měřítka, viz. Obr. 7.
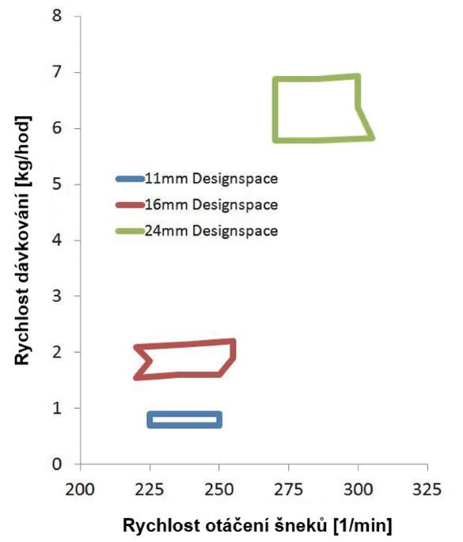
Obr. 7 – Návrhový prostor pro přenesení podmínek z laboratorního na výrobní měřítko
Při přenesení podmínek z „návrhového okna“ systému Pharma 11 na systém Pharma 16 je třeba pouze zvýšit rychlost dávkování. Při přechodu na systém Pharma 24 je kromě rychlosti dávkování nutno zvýšit také rychlost otáček šneků. Pokud zvětšíme velikost systému, tak se plocha vnitřního povrchu zvětšuje s mocninou na druhou. Zatímco pokud se zvýší rychlost dávkování, tak se objem extruderu zvětšuje se třetí mocninou. Se zvyšující se velikostí extruderu se tedy poměr mezi plochou povrchu vedoucí teplo a objemem materiálu uvnitř zmenšuje. Proto je třeba dodat další energii zvýšením rychlosti otáček šneku. Plocha „návrhového okna“ se při zvětšování systému rovněž zvětšuje. Při optimalizaci je nutno brát v úvahu také následné zpracování, kterým může být peletizace (Obr. 8), ale také produkce vícevrstvých materiálů, injektovatelných implantátů (MiniImplant Line, SteriCut System) nebo vloček (Chill-Roll/Flaker).

Obr. 8 – Kompletní sestava Pharma 16 (Thermo Fisher Scientific), modularita systému
Procesní parametry zoptimalizované na laboratorním extruderu lze přenést na geometricky identický extruder vhodný pro pilotní či provozní měřítko. Je však třeba upravit teoreticky stanovenou hodnotu kapacity systému. Na praktickém příkladu bylo ukázáno využití specifické spotřeby mechanické energie a vícenásobné regresní analýzy pro nalezení vhodného „návrhového okna“ při přenosu parametrů. Důležitá je i vhodná metodika pro stanovení průměrné doby zdržení příliš neovlivňující její distribuci. Kontinuální monitorování taveniny pomocí kamery a automatizované vyhodnocení umožňují zaznamenat dobu zdržení, důležité je nalézt optimální množství traceru. Pro termolabilní látky, zejména API je nutno stanovit také teplotu tání a tlak a najít optimální podmínky extruze tak, aby nedocházelo k jejich degradaci. Tyto podmínky lze charakterizovat pomocí reologických testů a urychlit tak optimalizaci podmínek extruze pro danou konkrétní API a charakterizovat hotový produkt.
Pomocí reologických experimentů s využitím kombinovaných reologických technik (RheoScope tj. reometr + mikroskopický modul s CCD kamerou, Rheonaut tj. reometr + FTIR) lze popsat řadu klíčových vlastností daného materiálu, tj. teplota skelného přechodu (DTMA), tání, měknutí, tokové křivky, stupeň krystalinity (RheoScope), distribuci molekulové hmotnosti polymeru (DTMA+MWD), tokové indexy a mnohé další [4] a urychlit tak optimalizaci podmínek HME.
Mgr. Anna PLESKAČOVÁ, Ph.D., PRAGOLAB s.r.o. ( pleskacova@pragolab.cz )
Nenechte si ujít další zajímavosti
- Vanquish Access – dostupné řešení spolehlivých HPLC analýz
- Psychoreologie a tribo-reologická charakterizace pudinků ve vztahu k textuře
- Adsorbovatelné organické fluoridy (AOF): Klíč k modernímu monitoringu PFAS ve vodě
- Elementární rozbor whisky pomocí icp-ms: detailní pohled do stopového světa oblíbeného destilátu
- Thermo Scientific Cindion C-IC (Combustion Ion Chromatography) - komplexní řešení pro stanovení celkových halogenů a síry ve složitých matricích